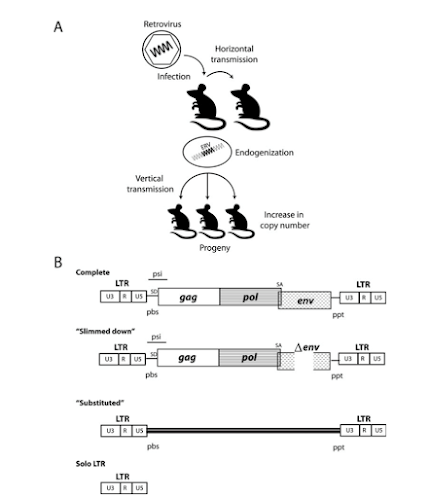
גנים קופצים, גנים מובילים, Selfish DNA ושמות נוספים.
הטרנספוזונים מהווים בבני אדם כ45% מהגנום.
הטרנספוזונים תורמים למגוון באוכלוסייה וכמובן למוטציות, עשוים להשפיע על ביטוי גנים, ייצור גנים חדשים ספלייסינג וריאנט חדשים ועשויים לחולל מחלה.
הטרנספוזונים מתחלקים ל-2 קבוצות:
רטרו טרנספוזונים- קופצים ע"י copy patse דרך יצירת RNA cDNA, וחדירה למקום חדש כשהישן
נותר במקומו.
DNA טרנספוזונים- גזור והדבק. קופצים למקומות שונים בגנום, ללא הכפלה.
סוגי טרנספוזונים:
HERV- endogenous
retro viruses
דומים לרטרווירוסים, מאפיינים דומים, בעלי מקטעי LTR בשני קצוות הרצף, gag (reverse transcriptase), env.
Non LTR human retro transposons
אין להם רצפי LTR
- LINE
לחלק יש gag , הקבוצה
מהווה כ20% מהגנום
SINE- הנפוץ ביותר בגנום ההומני הוא Alu, כמליון מקטעים בגנום מהווה כ-10% מהגנום
בצמחים הטרנספוזונים מהווים כ90% מהגנום
אוטונומוס- LINES מכילים LTR ויודעים לבטא RT כך שיכולים לבצע
"קפיצה" בעצמם
נונאוטונומוס- כאלה שאינם מכילים את האנזים RT ואינם יכולים לקודד
בעצמם אבל משתמשים באנזים של אלמנטים קופצים אחרים הפעילים בו בזמן.
לדוג LINE L1- ORF2 מכיל את RT ואינטגראז. הRNA שנוצרים הופכים לDNA ונכנסים למקום חדש בגנום. בו בזמן בזמן שORF2 מתבטא הוא יכול לספק את האנזימים לטרנספוזונים שאין להם.
במח יש הרבה יותר קפיצות משאר הרקמות בגוף.
בעובר יש יותר קפיצות מהוריו.
מה שמאפשר genetic variation ויצירת טרנספוזונים חדשים.
בדכ קפיצה אינה משפיעה, האינטגרציה במקום לא משפיע והנזק יהיה קטן אם
בכלל.
כשיש אינטגרציה במקומות חשובים עלולה להגרם נזק ולחולל מחלה.
ישנן כ65 מחלות שנגרמות עי קפיצות טרנספוזונים.
לDNA methylation יש תפקיד מאוד חשוב
בהשתקת הגנים הקופצים עי hyper methylation.
קפיצות במח- L1 יכול לקפוץ בכל מיני אזורי במח. נמצאו כ80 קפיצות חדשות בכל תא באיזורים מסויימים במח.
טרם הובן תפקיד הקפיצה לפעילות המוחית .
פרומוטורים הממותלים בCpG iland לעיתים יש איבוד של
מתילציה בתהליך הסרטני ובעקבות כך אנו עשוים לקבל טרנספוזיציות חדשות.
יתכן ומדובר בpassenger mutation,
התפתחות מוטציה חדשה בתהליך סרטני שנגרם ממוטציה אחרת.
נבדק האם למתילציה יש השפעה על רגולציה של טרנספוזון L1.
שימוש ב5AZA נוקלאוזיד שאינו עובר מתילציה, אליו נקשרים DNMTs ולא יכולים להשתחרר. כך הם עוברים פרוטאוליזה. רמת DNMTs יורדת, במידה והתאים מתחלקים לא יהיו מתילציות.
רמות גבוהות של 5AZA גורמות להפעלת מנגנון DNA damage.
TSA- מעכב היסטון דה אצטילאז , כשניתן לבדו לא נותן
אפקט אבל בטיפול סינרגיסטי עם 5AZA נותן אפקט חזק.
בסרטן נראו ביטוי יתר של טרנספוזונים, יש נסיון לפתח שיטה לזיהוי סרטן
באמצעות ביטוי יתר של טרנספוזונים כמרקר או אפילו לפיתוח טיפול.
במקרי סרטן שונים עשויים להיות hypomethylation על LINES .
ניתן לראות בסרטן הערמונית, בדקו מתילציות על HERV בהשוואה לתאים נורמאלים. יש ביטוי יתר בסרטן
יש קשר בין דלקת וסרטן.
בשל פקטורים המופרשים בזמן דלקת המסייעים לתאי מערכת החיסון עשויים לגרום לאינדקציה של HERVS. בתוך כך עשוי להתבטא Env, חלבון המעטפת של הרטרוטרנספוזון. לעיתים ממש נוכל לראות ויריונים היוצאים מהתאים לאחר אקטיבציה. החלבונים המופרשים על פני התאים בעת בנית הויריונים גורמים להפרשת IL10 שהוא Immunosopressor (גורם להתמיינות לTreg) הרבה מקרי סרטן מנצלים את דיכוי מערכת החיסון ומצליחים להתחמק .
רב הטרנספוזונים הם "מאובנים" של וירוסים.
התאים יכולים לבקר את הקפיצות עי מתילציות ב DNA, חלבון CRAFT (?), Teterin,ומנגנונים נוספים שמונעים
ביטוי.
טרנספוזונים שקפצו בצמחים ואיפשרו ביטוי גנים תחת מצבי סטרס, הם
משמשים פרומוטור אלטרנטיב י כך שאם הטרנספוזון שקפץ הוא copy
paste אז הטרנספוזון המועתק והמקורי
עובדים על אותם אינדוסרים וברגע שגן אחד מופעל כולם מופעלים בשל היותם מופעלים עי
אותו פרומוטור- יופעלו גנים בשל הפעלת
הפרומוטור של הטרנספוזון ולא בשל הפעלה מבוקרת של הגן.
טרנספוזונים על אף היותם מושתקים רב הזמן, בקפיצותיהם מאיצים את
האבולוציה.
לעיתים זה יתרון מאחר והם מקנים יתרון סלקטיבי.
HERVS
Human endogenous retroviruses
רטרווירוסים שעברו מפרט אחד לאחר (הוריזונטלית) ובאישהו שלב עשו
אינטגרציה לגנום בתאי המין אשר מעבירים את המידע אל הצאצאים, כך הם עוברים בתורשה.
בעכבר- MERVS
LTR רצפים המאפשרים את הקפיצות- לעיתים שני
מקטעי LTR יכלאו ביניהם מקטע DNA שאינו ויראלי ויקפצו איתו
הלאה.
endogenous retroviruses- 3 סוגים α,β,γ משייכים על פי הומולוגיה לוירוס המקורי
הפריימר של הRT הוא tRNA תאי. לכל קבוצת רטרווירוסים יש tRNA אחר
HERVS מסוג 2 קופצים הרבה בעכברים.
דברים חיוביים באנדוגנוס רטרווירוסים-
1.
חלבון השייך
לאנדוג'נוס רטרווירוסים –syncytin המסייע בהדבקה של הוירוס
בתאים חדשים. הוא היוצר את השלייה. (השלייה מורכבת מתאים הצמודים זה לזה)
בכל יונק נוצרת השלייה עם החלבון syncytin
אבל בכל יונק, רטרווירוס אחר תרם את חלקו.
2.
אשה הרה,
אינה תוקפת את העובר שלה- ההשערה היא
שמערכת החיסון מדוכאת עי מרכיבי הenv של הרטרו וירוסים ומונעים
את פעילותה. L1 מתבטא בעובר- ראקטיבציה
של רטרווירוסים בעקבות המחיקה. כמו במצבי סרטן
3. ב- תאי גזע יש ביטוי של HERV H.
יש לו חשיבות ב maintenance של stemness.
כשעושים נוקדאון של HERV H
יש ירידה במרקרים של תאי גזע. כמו כן ביצירת stem cells יש עלייה בHERVH
יכול להשפיע על ביטוי גנים ולשמש ככואקטיבטור
Alus
בערך 1/3 מהCpG בגנום נמצאים על Alus. ככל שרצפי הAlu עתיקים יותר(נמצאים בגנום מליוני שנים) כך הם נמצאים באזורים שמורים יותר ויתהיה להם פונקציה יותר שמורה לעומת רצפים צעירים יותר.
לרצפים אלה יש ככל הנראה תפקיד כאינהנסרים, על פי המתילציות האופייניות לאינהנסרים, מאפייני האינהנסרים H3K4me1 –לא פעיל(על פרומוטור יהיה H3K4me3) אם יש חיבור של H3K27ac הוא יהיה אינהנסר פעיל.
H3K4me1 מודיפקציה האופיינית לאינהנסר. ניתן לראות
שככל שהAlus יותר "זקנים" כך המודיפיקציה הזו
משתלטת עליהם.
הAlus אשר מקבלים את
המודיפיקציה H3K4me1 מצביע על כך שהם אינהנסר
בpoise.
H3K4me3 פחות נראה בתרשים- מאפיין פרומוטור.
ככל שהAlus יותר ותיקים יש פחות
דיברסיטי- יותר שמורים, וכן עלייה בקישור מוטיבים שהם פקטורי שעתוק- תיאור של
אינהנסר מושתק.
מודל הפיכת מקטעי Alus לאינהנסרים:
Alus עם הזמן (ותק) הופכים להיות אינהנסרים עם
מאפיינים מתאימים.
הרבה מהAlus שנמצאים ליד גנים מאוד
דומים לאינהנסרים מבחינת מודיפיקציות על היסטונים.
Endogenose retro viruses
HERVS עשוים לשמש כפרומוטורים, אינהנסרים,
אינסולטורים, מקודדי פוליאדנילאציה ואיזורי קישור לפקטורים. כ320K איזורי קישור לפקטורי שעתוק רק עליהם. דבר המשפיע על שעתוק
במקומות אחרים באופן לא ישיר בשל התחרות כי יש המון אזורי קישור. בנוסף ליכולת
לשמש כאינהנסרים שיכולים לקשור פקטורי שעתוק.
רצף LTR יכול לשמש כאינהנסר, פרומוטור, סיגנל לפוליאדנילציה מתוקף תפקידו בוירוס הקדום.
השפעה על ביטוי גנים יכול להיות :
טיפול בתאי סרטן במעכבי immune modulation בשילוב
עם תרופות המעכבות DNMTs- HERVS הממותלים יאבדו את
ההשתקה, יבטאו ds RNA הגורם לאקטיבציה של
מנגנונים כנגד וירוסים בתאים( ,MAVS,MDA5, TLR3, שחרור אינטרפרון B מאקטבים תאי סרטן בסביבה)
טיפולים כמו anti
CTLA4 המאקטבים את מע' החיסון עובדים טוב יותר בשילוב.
בטיפול ב5AZA ניתן לראות יהיה
היפומתילציה של HERVS ויאפשר את אותו התהליך.
התא ש5AZA משפיע עליו מפריש
אינטרפרון בטא, יכול להשפיע על התאים בסביבה.
אם משתמשים בחומר המפעיל את MDA5, MAVS או IRF7 גורם לירידה בתאים הסרטניים.
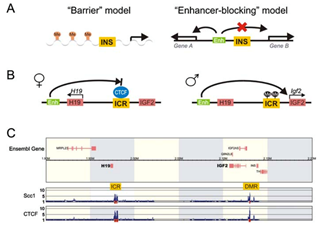
Insulators
יש צורך לבודד את תהליך הביטוי של גנים על מנת שלא יהיה ביטוי של גנים
סמוכים. האינסולטור הוא רצף DNA הקושר
חלבון בדכ CTCF שיכול להפעיל פקטורים
נוספים.
CTCF- חלבון המסייע ביצירת
לולאה וקירוב האינהנסר לפרומוטור
שני סוגים
1- Barrier insulators חוסם איזור מסוים שhetro chromatin לא יתפשט , יוצר גבול.
2- Enhancer- blocking insulators שומר שאינהנסר לא ישפיע על פרומוטורים סמוכים, חוסם את המעבר. בדכ יהיה בין האינהנסר לפרומוטור
חלבונים הקושרים הטרוכרומטין- HP1 (hetro chromatin protein 1), קושר היסטון3 ממותל, וsuvar (עושה H3K9me3) המגייסים זה את זה ומגבירים זה את פעילותו של זה- הגברת הטרוכרומטין הbarrier insulator עוצר את התפשטות הכרומטין.
HP1, suvar ודה אצטילציה ומתילציה של היסטונים. האינסולטור צריך להביא חלבון עם HAT activity שכל הזמן עושה אצטילציה של היסטונים.
קומפלקס הקוהזין , נמצא שCTCF עובר אינטראקציה עם
קוהזין. ביטוי CTCF וקוהזין עולה באותו זמן
יCTCF הוא הפקטור המביא את
חלבון הקוהזין
שניהם חשובים כאינסולטורים כקומפלקס (לא בזמן חלוקה)
קישור CTCF לאיזור הקישור שלו מושפע ממתילציות. מתילציה מונעת קישור CTCF
מחלה המתאפיינת בגדילה של איברים-
סינדרום VWS נגרמת בדכ ע"י DNA methylation במצב נורמאלי יש מתילציה על אלל מהאם/ האב
ולבטא אלל אחד. שינויים במתילציה עשוי לגרום לחוסר בביטוי או ביטוי כפול של שני
האללים.
אינטראקציה בין אינהנסר
ופרומוטור בלופינג (קומפלקס קוהזין CTCFו)
אינהנסר משפיע רק על פרומוטורים שעל אותו הכרומוזום