בחלק זה יוצג סדר וזהות המשתתפים בדיכוי ביטוי הגן.
להלן הניסוי שהראה בפעם הראשונה שמתילציה/אצלטילציה/פוספורילציה אינה
מתרחשת בשל המטען החשמלי אלא היא תלויית מקרה ומדוייקת מאוד, הספציפיות הזאת נובעת
מהעובדה שלכל שינוי אפיגנטי מתאים קוד מסוים (ראה איור למעלה), לדוגמה ליזין
במיקום 4 יכול לעבור מתילציה, ליזין במיקום 9 יכול לעבור אצטילציה לעומת
זאת...הסה"כ שינויים באותו מקטע מייצג קוד והוא זה שיקבע האם יהיה כאן ביטוי
או השתקה.
הטרוכרומטין – האזור בו הדנא ארוז בצורה צפופה אינו זמין לפולימרז.
אאוכרומטין - האזור הפתוח.
את ההטרוכרומטין מחלקים לפקולטטיבי – שונה בין תאים, זאת אומרת
שיכול להיות הטרוכרומטין בתא אחד ואאוכרומטין באחר. קונסטיטוטיבי – אזור של
הכרומטין שיהיה דחוס ולא זמין בכל התאים.
את המידע הבא הסיקו משימוש בכרומוזום פוליטן -
Polytene
chromosomes are
oversized chromosomes which have developed from standard chromosomes and are
commonly found in the salivary glands of Drosophila melanogaster.
הגן W לכשמתבטא,
מביא לעין אדומה (נכון זה הפוך מהאינטואיציה) בתמונה לעיל נראה שהגן עבר למקום
בכרומוזום שנמצא במצב הטרוכרומטי כלומר אינו בא יותר ליידי ביטוי ואז העין הופכת
ללבנה.
החלבון HP1 אחראי על שמירת הטרוכרומטין בצורה חזקה יותר
ובעצם דיכוי ביטוי גנטי חזק יותר.
כאשר קיימת מוטציה בגן המקודד לחלבון אנו נראה פחות הטרוכרומטין
ולכן ביטוי רחב יותר של גנים וביניהם W ועיניים
אדומות יותר. ביטוי בייתר של שהחלבון יביא חדיכוי חזק יותר ועין לבנה יותר.
עוד דוגמה לחלבון חשוב בשמירה על
ההטרוכרומטין הוא ה SU(VAR)3-9 .
נראה מאמר ובו נראה שהחלבון ההומולוגי שלו בבני אדם ובעכברים מביא
למתילציה של היסטון3.
להלן מוצג ניסוי שמסביר כיצד גילו את המיקום המדוייק של המתילציה וזאת
על ידי יצירת מטציה נקודתית בכל אחת מחומצות האמינו שבקצה האמינו של היסטון 3
ובדיקת מתילציה ועל ידי כך הסיקו כי המיקום המדוייק הינו ליזין9 או .K9 לאחר מכן הם סינטזו את הפפטיד ושילבו בתוכו כל מיני מוטציות אקראיות.
אם הליזין 9 הוא עם קבוצת אצטיל, לא ניתן להוסיף לו קבוצת מתיל, זאת
אומרת שבניסוי הראו בעצם את חשיבות HDACS על מנת לאפשר מתילציה
לאחר מכן.
מתילציה:
It is the introduction of an
Methyl functional group to Lysine or Arginine of the histone tail. These
histone methyltransferase (HKMTs) catalyse the transfer of a methyl group from
S-adenosylmethionine (SAM) to ‘Arg’ can be methylated once or twice, and ‘Lys’
once, twice of trice.
המתילציה מתבצעת על ידי המתיל טרנספרז והקו פקטור שלו – SAM , היעדים שלו הינם ארגינין או ליזין.
אנזימים מסויימים יכולים לבצע מתילציה בודדת ואחרים מסוגלים לבצע כמה
בו זמנית, כמות המתילציות מביאה לפעילות שונה ולאוו דווקא למוגברת או ירודה. אותן
התכונות בדיוק נכונות גם לאנזימים שמבצעים דה מטילציה.
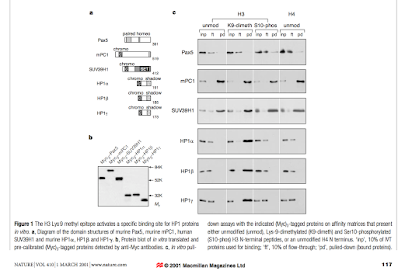
להלן מוצגים לנו התכונות של SUV ו HP1 , כאשר מה שאנו רואים זה
שSUV נקשר לכל הגורמים הנחקרים במאמר ובעוד HP1 נקשר בהעדפה רבה יותר לליזין9 די מתיל—מכאן אנו יכולים לקשר את
העובדה שראינו מוקדם יותר שחלבון זה הינו אחראי להטרוכרומטין, ולכן דימתילציה על
ליזין9 הינה באסוציאציה לדיכוי ביטוי גנטי.
סיכום של מה שהוצג והוסק עד כה:
בעצם אנו רואים שקבוצת המתיל הקיימת על גבי חומצת
האמינו מהווה נקודת חיבור לחלבון HP1 אשר
מגיע לנקודה זו עם "חברו" SUV39 אשר
בתורו מסוגל לבצע כעת את פעילותו של מספר מתילציות בו זמנית באותו שייר. אנו
מקבלים בתהליך זה בעצם מצב הנקרא התפשטות של מתילציות או SPREADING ובו אזור מסוים הופך לממותל
בצורה חזקה לאחר הגעת הקומפלקס של שני החלבונים התלויים זה בזה לפעילותם.
להלן ניסוי שבו הראו שפוספורילציה על גבי סרין10
הצמוד לליזין9 מונעת את החיבור של 1HP.
יש מספר האפשרויות של השינויים הנראים בהיסטון ומהם אנו
מסיקים כי שלושה מארבעת השינויים מביאים לאותה התוצאה- חוסר יכולת חיבור HP1 לחומצת האמינו.
HP1
binding, three of four combinations of marks (unmodified H3, H3S10P, and
H3K9me3S10P) lead to the same output (no HP1 binding), so the four possible
combinations still only yield two biological outputs.
רק מתילציה יחידה תביא לקשירתו.
סיכום של אנזימים רבים הפועלים על זנב ההיסטון:
ישנה חלוקה בין האנזימים לכאלה שכותבים WRITERS ומבצעים
את השינויים עצמם וכאלה שהם READERS אשר
קוראים ומזהים את הקוד המובע בעזרת חומצת האמינו והמודיפיקציה הקיימת או לא ביחד
עמה וקוראים לחלבון או אנזים אשר עתיד לבוא למיקום זה.
להלן מוצג ניסוי שבוצע על נמלים, הנמלים התחלקו ל MAJOR ו
MINOR כאשר
הראשון מתרחק מהקן והשני לא. כאשר הזריקו
לנמלים את ההיסטון דה אצטילאז אינהיביטור הנלים התנהגו יותר כMINOR ואלה
שהוזרק להן HATi לעומת
זאת הן התנהגו יותר כמו MAJOR.
בניסוי הבא בדקו את השפעת הLSD1 על השתקה של גנים, בניסוי מצאו השפעה שלו על 4K3 H(המביא לביטוי גנטי) וראו שיש לחומר זה השפעה של דיכוי הנגרמת בעקבות הסרת מתיל משייר זה.
ישנם עוד מספר גורמים המשפיעים על הביטוי הגנטי כאשר
ACV או ACICLOVIRמונע רפליקציה של ווירוסי הרפס.
המסר העיקרי הוא איך הראו את השפעת החומרים הנל על
רמות הביטוי של הגנים של התאים ושל הווירוס המודבק בתאים אלו כתוצאה מפעולתם:
נערכה
השוואה בין DMOG אשר גרם לירידה
בביטוי הגן הוויראלי ICP וחוסר ההשפעה של ACV שכן הוא מונע
רפליקציה וויראלית בצורה שונה, מוצג כאן בעצם מנגנון שונה וחדש מזה הקיים
להתמודדות עם הווירוס.
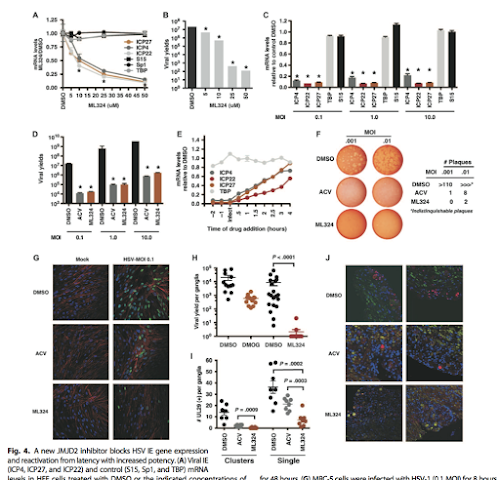
בניסוי הבא הראו השפעה של חומר שונה –ML324 אשר בניגוד לדוגמה הראשונה הוא כן משפיע על
הרפליקציה של הווירוס בדומה ל ACV ומונע מעבר של הווירוס לשלב הליטי.
בניסוי הראו כיצד השפעת LSD1 משפיעה גם על
ביטוי גנים וויראלים במקרה זה CMV ומביאה
לירידה בביטוי.
כעת נצא קצת מחוץ לדוגמה:
בגנום ישנם הרבה ORI אך רק חלקם יבואו
ליידי ביטוי, זאת כתלות במיקומם בהטרו/אאוכרומטין.
בנסוף לכך ישנו פקטור חשוב המשפיע על הביטוי הגנטי,
המיקום של חלקי הכרומוזום, המייצגים את הגנים אשר יבואו ליידי ביטוי בשלב מוקדם או
מאוחר במהלך המחזור התאי.
בירוק נמצאים הגנים היותר זמינים אשר יבואו ליידי
ביטוי בשלב המוקדם ואלה באדום מייצגים גנים במצב דחוס יותר אשר פחות זמינים ויבואו
ליידי ביטוי רק בשלב מאוחר יותר.
בניסוי הבא הוזרק לתאים זהים הנמצאים בשלבים שונים
במחזור התא פלסמיד המכיל גן ובדקו האם הביטוי שלו יהיה זהה בכל התאים. הם הראו שכל
תא ביטא את הגן ברמה שונה ובהתאם לשלב בו התא היה בעת ההזרקה.
בשלושת הניסויים האחרונים בעצם חזרו על אותו העיקרון
ובדקו ביטוי גנים כתלות בשלב במחזור התא :
כאן נבדקה רמת השפעת TSA על הביטוי הגנטי
כתלות בשלב.
וכאן נבדקה רמת השילוב של הנוקלאוטיד BRDU בתוך פלסמיד שהודבק
בתאים ועבר אינקורפורציה בדנא של התא (בעצם הוסיפו כאן בדיקה של דנא תוך גנומי
בניגוד לחוץ גנומי שהוצגו עד כה) כתלות בשלב במחזור התא.